| Esquema |
1. Características de las reacciones metabólicas.
Se denomina reacción metabólica a aquella que tiene lugar entre las biomoléculas presentes en un organismo vivo.
Características:
- Las reacciones metabólicas actúan secuencialmente.
- Existen rutas convergentes y divergentes.
- Las más importantes son comunes en la mayoría de los organismos.
- Todas son catalizadas por enzimasSe pueden clasificar entre anabólicas, catabólicas o anfibólicas.
.
2. Enzimas
Las enzimas son proteínas que actúan como biocatalizadores. Pueden estar compuestas solo por cadenas polipeptídicas o contener algún grupo no protéico.
Cuando contienen un grupo no protéico se diferencian dos partes:
- Apoenzima: parte protéica, contiene el centro activo.
- Parte no protéica o cofactor: que puede ser un ión metálico o un compuesto orgánico al que se denomina coenzima o grupo prostético, cuando la unión es permanente.
2.2 Propiedades de las enzimas
Poseen las mismas que las proteínas.
- Se desnaturalizan por cambios de pH, temperatura o concentración salina.
- Presentan una gran especificiad
- No se consumen en el transcurso de las reacciones.
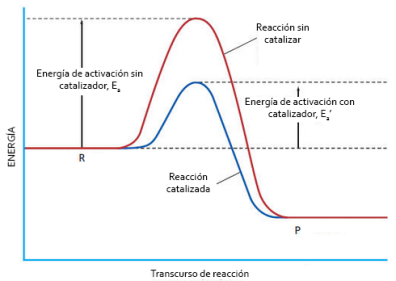
2.3 Mecanismo de las reacciones enzimáticas.
 |
| Fuente |
Etapas de las reaciones catalizadas:
- El sustrato se une al cetro activo de la apoenzima formando el complejo ES, la unión es lenta y reversible. Existen dos formas de unión: Modelo de la llave cerradura: El cetro activo posee por si solo la forma complementaria al sustrato y Modelo de ajuste inducido: Cambia su forma según la del sustrato.
- Se lleva acabo la reaccion y se obtiene el producto final. Es irreversible y rápida.
- Se libera el producto del centro activo y el apoenzima queda libre.
3.Cinética enzimática
Al aumentar la concentración de sustrato aumenta la velocidad de la reacción. Se alcanza una velocidad máxima cuando no existen moléculas de enzima libre.
Una forma de estudiar la velocidad de una reacción enzimática es lcular la constante de Michaelis-Menten (Km): concentración de sustrato para la cual la reacción alcanza la velocidad semimáxima. La Km es característica de cada enzima y cuanto menor sea su vaor, mayor afinidad tendrá la enzima por el sustrato.
- Concentración de sustrato
- El pH
- La temperatura
5. Mecanismo para aumentar la eficacia enzimática
- Compartimentación celular.
- Reacciones en cascada.
- Complejos multienzimáticos
- Existencia de isozimas.
6. Regulación de la actividad enzimática.
Permite que solo permanezcan activas las enzimas precisas en cada momento. Los mecanismo empleados son:
- La activación. La presencia de activadores permite que ciertas enzimas que se mantenían inactivas lleven a cabo su acción. Algunos cationes y diversas moléculas orgánicas, incluso el propio sustrato pueden actuar como activadores.
- La Inhibición. La enzima, previamente activa, disminuye su velocidad o deja de actuar cuando aparece un inhibidor, el cual puede ser un ion o también una molécula orgánica y, muy frecuentemente, el producto final dela reacción.
- El alosterismo. Las enzimas alostéricas están formadas por varias subunidades; poseen varios centros de regulación; adoptan dos conformaciones distintas según sea la afinidad por el sustrato; existe un efecto cooperativo entre las subunidades; su cinética es diferente a la del resto de enzimas.
Las vitaminas
Las vitaminas actúan como cofactores y son moléculas lábiles. Se obtienen a partir de alimentos vegetales o provitaminas y el déficit o exceso de estas puede originar transtornos o enfermedades.
Se clasifcan en:
- Liposolubles
- Hidrosolubles
Apartado desarrollado
6. Regulación de la actividad enzimática.
Las necesidades celulares son cambiantes y, por tanto, la velocidad de las reacciones enzimáticas debe variar de acuerdo con ellas. Los mecanismos de regulación son la activación e inhibición enzimáticas y el alosterismo.
6.1 Activación enzimática
La unión del activador hace que el centro activo adquiera la estructura adecuada para el acoplamiento del sustrato. Pueden actuar como activadores los iones Ca 2+ y Mg 2+, diversas moléculas orgánicas e incluso el propio sustrato.
6.2 Inhibición enzimática
La enzima disminuye su velocidad o deja de actuar con la presencia de un inhibidor que puede ser un ion, una molécula orgánica o el producto final del a reacción (retroinhibición).
La inhibición puede ser irreversible cuando el inhibidor se une covalentemente a la enzima o reversible cuando se une por enlaces no covalentes.
Según el lugar de unión se diferencian dos tipos de inhibición reversible:
- Inhibición competitiva: El inhibidor se une al centro activo impidiendo la unión del sustrato, existe una competencia entre ambos para ocupar el centro activo. Su forma es semejante a la del sustrato, por eso se les llama análogos metabólicos. En la actualidad se usa para la síntesis de fármacos, por ejemplo las sulfamidas para el tratamiento de infecciones bacterianas.
- Inhibición no competitiva: El inhibidor no se une al centro activo, se une a otro lugar. Dicha unión modifica la estructura de la enzima y dificulta el acoplamiento del sustrato. En otras ocasiones el inhibidor se une al complejo ES e impide la formación del producto.
6.3 Alosterismo
El alosterismo constituye un sistema de regulación enzimática preciso. Las enzimas alostéricas catalizan reacciones importantes. También suelen encontrarse en los puntos de ramificación de las rutas metabólicas.
Características:
- Están formadas por varias subunidades.
- Poseen varios sitios para la unión de activadores e inhibidores.
- Adoptan dos conformaciones distintas, estado R (en el que la afinidad por el sustrato es alta) y estado T (en el que la afinidad es baja). El primer estado se estabiliza cuando llos centros reguladores tienen unidos activadores y el segundo cuando tienen unidos inhibidores.
- Existe un efecto cooperativo entre las subunidades.
- Su cinética es diferente a la del resto de las enzimas. Ver gráfica.
 |
| Fuente |
| Fuente |




No hay comentarios:
Publicar un comentario